鉛酸電池是現代工業上普遍使用的電池,
而主要的原料就如同其名『鉛酸』電池--
鉛、二氧化鉛還有硫酸!
 |
| 引用自:http://webarchive.ncl.edu.tw/archive/disk19/55/57/00/57/47/201112073041/20121202/web/fbblife.com.tw/25152361/article/contentd734.html?ArticleID=1074 |
鉛酸電池之所以好用,主要有兩個原因:
1.可以充電,而不像伏打電池一樣是一次性的電池。
2.內電阻小,可作大電流放電
鉛酸電池各部為材料如圖
(PS:這是新式的免加水電池。):
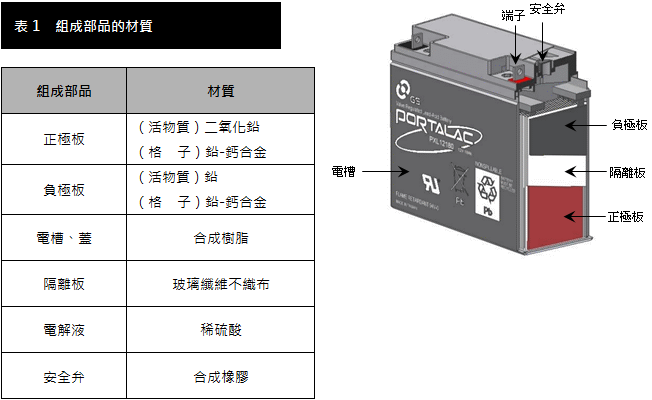 |
| 引用自:http://www.gs-battery.com.tw/knowhow-technicalmanual-3.php |
所以,以我自己機車用的電池,湯淺YUSHA TTZ14S為例:
電解液是稀硫酸,
所以這才叫做『鉛酸』電池阿!
將硫酸溶液倒進電池中。
在放電的時候,
負極反應為:
(1)Pb+H2SO4
→ PbSO4+2e-+2H+
負極的鉛板(Pb)與硫酸(H2SO4)反應,
而鉛板行氧化反應與硫酸結合形成硫酸鉛(PbSO4),
並釋出兩個電子(2e-)經由外電路到正極,
而硫酸解離出的兩個氫離子(2H+)也釋出到電解液中。
(Ⅰ)Pb+SO42-→
PbSO4+2e-
也可視為負極的鉛板(Pb)與硫酸解離後的硫酸根(SO42-)反應形成硫酸鉛(PbSO4),
並釋出兩個電子(2e-)經由外電路到正極。
(PS:硫酸解離出的兩個氫離子(2H+)在此先不描述,因為在正極反應中會消耗掉。)
正極反應為:
(2)PbO2+2H++H2SO4+2e-
→ PbSO4+2H2O
正極的二氧化鉛(PbO2)與硫酸(H2SO4)反應,
而二氧化鉛行還原反應與硫酸結合形成硫酸鉛(PbSO4)並兩個由負極經由外電路到正極的電子(2e-),
而正極硫酸解離出的兩個氫離子(2H+)與負極產生的氫離子與氧形成兩個水分子(H2O)。
(Ⅱ)PbO2+4H++SO42-+2e-
→ PbSO4+2H2O
也可視為正極二氧化鉛(PbO2)與硫酸解離後的硫酸根(SO42-)反應形成硫酸鉛(PbSO4),
而正極硫酸解離出的兩個氫離子(2H+)與負極產生的氫離子,
再接受兩個由負極經由外電路到正極的電子(2e-)與氧形成兩個水分子(H2O)。
因此放電的總反應式:不論是(1)+(2)或是(Ⅰ)+(Ⅱ),都是:
PbO2+2H2SO4+Pb → 2PbSO4+2H2O
EX:
(1)Pb+H2SO4
→ PbSO4+2e-+2H+
+(2)PbO2+2H++H2SO4+2e- → PbSO4+2H2O
= PbO2+2H2SO4+Pb
→ 2PbSO4+2H2O
充電的時候,必須接外部電源,以正極接正極,負極接負極的方式才能充電。
而充電時,正負兩極的化學反應都是放電時的反應將反應物與生成物互換。
例如:
負極在放電時反應為:Pb+H2SO4 → PbSO4+2e-+2H+
負極在充電時反應為: PbSO4+2e-+2H+→Pb+H2SO4
但要特別注意的是,他們並不是『可逆反應』,是發生條件不同。





沒有留言:
張貼留言